2020年3月26日,艾尔建公司的“青光眼引流管XEN Glaucoma Treatment System”产品通过了国家药品监督管理局(NMPA)上市审批 ,该产品在注册中使用了临床真实世界证据进行人种差异评价,是国内首个使用真实世界证据而取得上市批准的医疗产品。说到真实世界证据,就不得不引出近年来大热的“真实世界研究”(Real World Study, RWS)。
真实世界研究,是指针对预设的临床问题,在真实世界环境下收集与研究对象健康有关的数据(即真实世界数据,Real World Data,RWD)或基于这些数据衍生的汇总数据,通过分析,获得医疗产品的使用情况及潜在获益或风险的临床证据(即真实世界证据,Real World Evidence,RWE)的研究过程。换言之,RWS的目的是用来说明某种医疗产品对于研究对象健康的影响,评价医疗产品的安全性与有效性。
肯定有人会问,在RWS出现之前,评价医疗产品的效果难道是通过虚拟世界研究吗?其实在RWS被探讨与关注之前,医疗产品安全性与有效性评价的传统金标准是随机对照试验(Randomized Controlled Trial,RCT)。RCT是基于科学设计后的对比试验,力求最大限度的减少其他因素对疗效的影响。由于RCT所体现的因果关系较为确定,其结论可靠性高。
用一句话来总结RCT与RWS的应用区别:当我们想知道使用某一医疗产品进行干预是否有明确的治疗效果时,就需要采取RCT设计;当我们需要进一步研究采取该干预措施在日常医疗实践中的应用效果和安全性时,就需要采取RWS设计。
RWS一般在实际医疗服务环境下开展,受试者具有广泛代表性,试验证据与个体患者特征相结合进行有意义的疗效受益和安全风险评估,这时试验所得证据是最适用于临床实践的。精心设计的RWS,可以用来作为对RCT研究的补充,去检验一种已经认为有效的治疗措施在真实医疗实践中的有效性和安全性。在实际研究中,由于需要大的样本量且相对较长的随访时期,开展RWS的成本可能是非常昂贵的。RWS最大优势在于它可以为日常真实临床环境下治疗措施的有效性和安全性提供证据,但其风险可能是牺牲了内在有效性。
随着医疗信息化、人工智能与深度学习技术的发展,通过对临床中取得的各类健康数据的科学分析,专业人员能够发掘出对医疗产品安全性及有效性评价的研究结果。这些基于真实世界数据的研究,一方面将大幅提升传统对照试验的研究速度,另一方面也可以尝试证明传统对照试验无法解答的问题。经过严谨的科学设计,RWS有可能成为对医疗产品传统评价标准RCT的有利补充。
RWS的方法形成之后,在较短时间之内获得了社会各界的重视。我们根据时间轴整理了中国在RWS领域重要的里程碑事件:
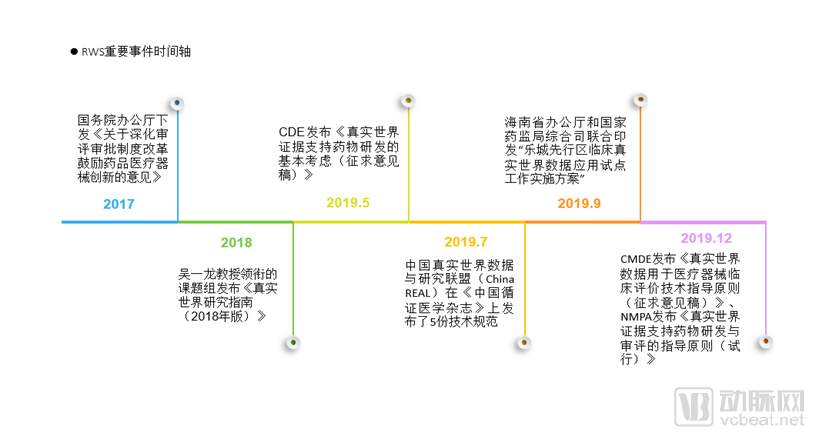
1.国务院于2015年8月下发的《关于改革药品医疗器械审评审批制度的意见》、国务院办公厅于2017年10月下发的《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》均大力倡导药品和医疗器械的研发创新。
2.吴一龙教授领衔的课题组在2018年8月召开的中国肿瘤学临床实验发展论坛上发布《真实世界研究指南(2018年版)》,是RWS在我国第一次系统化亮相。该指南介绍了RWS相关概念并对RWS的流程、设计、数据采集、质量控制提供了系统性的建议和指导。
3.国家药品监督管理局药品评审中心(CDE)于2019年5月发布《真实世界证据支持药物研发的基本考虑(征求意见稿)》,RWS的应用场景和对RWS的研究要求第一次进入了官方视野。
4.中国真实世界数据与研究联盟(China REAL)围绕着如何建立研究型数据库、如何开展治疗结局的评价发布了5份详实的技术规范。(i) 技术规范1主要针对典型的既有健康医疗数据构建研究型数据库的技术要求展开讨论,技术规范2详细讨论了构建患者登记库的关键技术要求,这两个技术规范主要回答了“如何基于RWS,建立研究型数据库”。(ii) 技术规范3和4主要针对利用研究型数据库,基于观察性设计评估治疗结局(有效性和安全性)的流行病学设计和统计分析问题,技术规范5主要讨论实效性临床试验的相关技术要求,这三个技术规范主要解决“基于RWS如何开展评价治疗的有效性和安全性”。
5.海南省办公厅和国家药监局综合司在2019年9月联合印发“乐城先行区临床真实世界数据应用试点工作实施方案”,决定在乐城国际医疗旅游先行区试点对临床急需进口药械的真实世界研究。
6.2019年12月13日,国家药品监督管理局医疗器械技术审评中心(CMDE)就《真实世界数据用于医疗器械临床评价技术指导原则(征求意见稿)》(“《RWS用于医疗器械指导原则》”)公开征求意见。
7.2020年1月3日,NMPA发布《真实世界证据支持药物研发与审评的指导原则(试行)》(“《RWS用于药研指导原则》”)。
在上述文件中,最后两份文件较为重磅,我们通过下表列举了国家已经认可或者拟认可的RWS应用场景:

表:RWS应用场景
根据上述两份指导原则,RWS可以分为干预性研究和非干预性研究两种类型:
(1)干预性研究又被称为“实用临床试验”(Pragmatic Clinical Trial,PCT),其会尽可能接近临床真实世界环境,特定干预因素的设计会较为灵活,信息搜集依赖于该等临床实验中的医疗实践。开展PCT时,同样需遵守我国就医疗产品临床试验的监管要求。
(2)非干预性研究包括观察性研究(回顾性或前瞻性)以及作为单组试验研究的外部对照类研究(历史对照或平行对照)等,信息搜集依赖于日常的医疗实践。对于非干预性的研究,研究过程中仍可能需要受试者的配合。
另一方面,我国法律法规对于临床试验的定义并非以干预作为判定标准,与人体相关的临床研究均应遵守临床试验的各类监管要求。这样的监管要求符合国际惯例,人用药品注册技术要求国际协调会(ICH)制定的临床试验管理规范(Guideline for Good Clinical Practice, GCP)是对于药物临床试验国际通用的重要指导原则,根据GCP的规定,临床试验与临床研究视为相同的概念。RWS同样应遵守临床试验的监管要求,下表简要概述了RWS应符合的监管要点:

在上述监管要点中,伦理委员会的监督是一个非常重要的环节,伦理委员会的构成会包括医疗领域的专家和临床试验机构之外的独立人士,其审核的重点材料包括参与临床研究受试者的知情同意书。
对于基于大数据展开的回顾类观察性研究和历史对照类研究而言,由于使用的是已经存在的数据,取得受试者的知情同意往往存有一定难度。根据《涉及人的生物医学研究伦理审查办法》(“《医学研究伦理办法》”)的相关内容,(1) 利用过去用于诊断、治疗的有身份标识的样本进行研究的,研究者应当获得受试者签署的知情同意书;(2) 利用可识别身份信息的人体材料或者数据进行研究,已无法找到该受试者,且研究项目不涉及个人隐私和商业利益的,经伦理委员会审查批准后,可以免除签署知情同意书。鉴此,我们可以合理推断,在对数据进行去标识化处理后且在确保不会侵犯个人隐私的前提下,对于特殊的RWS研究(比如:非干预且仅适用历史健康数据的研究),伦理委员会有一定的裁量空间,可适当豁免让受试人再次签署知情同意书的这个程序。
以《网络安全法》为基石,目前全国多个围绕《网络安全法》的配套性法规以及关联性法律制定工作均在紧锣密鼓推进中,包括《网络安全等级保护条例》与《个人信息安全规范》、《数据安全法》和《个人信息保护法》均已启动立法进程。《信息安全技术-个人信息安全规范》在2020年3月正式亮相,该规范作为推荐性国家标准,对互联网行业的个人信息保护具有很强的示范指导意义。
我国医疗健康数据的监管规范主要包括《国家健康医疗大数据标准、安全和服务管理办法(试行)》、《人口健康信息管理办法(试行)》及《人类遗传资源管理条例》等,这些规范性文件体现了如下监管原则:(1) 采集数据并控制数据的医疗卫生机构及企事业单位是数据安全保护和应用的责任单位,责任单位应确保医疗健康数据获得有效的网安保护、隐私保护并确保数据在采集时的授权范围内使用;(2) 不得将人口健康信息在境外的服务器中存储,不得托管、租赁在境外的服务器;(3) 对于可能涉及国家秘密(如:人类遗传资源)的数据利用,应取得相应主管部门的事先许可。
根据公开新闻报道,在海南省的试点地区,相关主管部门已联合专家学者和NMPA的有关审评部门制定了《海南博鳌乐成国际医疗旅游先行区临床急需进口医疗器械临床使用数据收集初步方案》 ,但很遗憾该等方案并未公开,社会公众暂不得而知其中具体细节。
尽管如此,结合目前信安领域的实践,一般而言,RWS的申办者、研究者与相应的临床试验机构、医疗健康数据的提供方首先应就数据的授权使用签署书面协议并确保数据使用或采集不会涉及到个人信息的泄漏及个人隐私的侵犯。但是,除此之外,关于实验数据如何进行数据脱敏、数据脱敏后患者是否还应就RWS的相关内容享有知情权、超出授权范围的患者数据使用应如何获得赔偿且赔偿标准如何认定、NMPA是否与卫健委共同对数据安全进行监管等诸多问题,还有待于政府主管部门的细则给出进一步的答案。
结语:中美两国正在展开激烈的竞争,其中医疗领域的创新活动是该竞争的主旋律之一,此次新冠疫情更加凸显了医疗科研创新领域的重大进展将对社会整体安全的决定性作用。我们期待RWS助力全球医疗创新的进步,更期望我国的医疗法律体系对于RWS进行包容性监管,以加快中国医疗创新的进程。
本文作者:安杰律师事务所大健康团队

联系人二维码

蔡航律师介绍:十余年来专注于医疗健康、TMT、人工智能领域的投融资服务,在中国风险投资法律服务领域具有巨大的影响力。《商法》杂志将他列为“中国法律精英100强”,认为他是中国最出色的商事律师之一。他还多次获得Legal500、Legalband等法律评级机构在TMT、风险投资领域的推荐。除了风险投资业务之外,他还精通并购与资本市场等业务。蔡航律师是安杰律师事务所上海办公室的执行事务合伙人。

张茵律师介绍:代表境内外知名基金完成了大量的投资、并购交易,同时为企业客户的投融资交易提供法律服务,涉及的行业主要包括医疗健康、生物制药、人工智能、娱乐传媒、旅游等领域。在大健康合规领域,张律师协助医疗企业深度参与互联网医院合规事宜,并代表客户完成了对多家医疗机构、医疗互联网企业的收购。






























